Aluminiu Cuprins Istoric | Proprietăți | Compuși | Răspândire | Producere | Utilizare | Note...
Aluminiu
element chimicsimbolul13mineralelorfiermetaluldensitatecupruoxidacid azoticoxigenPliniu cel Bătrânmetalmedicinăanul1760oxidmetalicaluminăchimistulfrancez1807sodiuluipotasiuluibariuluistronțiuluicalciuluimetalicăNapoleonmetalelorcarbonuluihidrogenului1808boroxiduluipotasiuelectroliză1821oxidMineralulbauxitămetalicchimistuldanez1825mercuricpotasiuluiMercuruldistilaregrioxid1827potasiulmetalicPotasiulmetalhigroscopicității1854Chimistulfrancez18461859sodiuluipotasiuluiargintul188618891866metalului18861887SydneyAustralia190019391943al Doilea Război Mondialmetale2008iuliedecembrieoxizisulfuricloruridensitățiiAlamăAluminiuAmalgamAntitaenitArgintAurAuricupridAvaruitCabriitCadmiuCromCupalitCupruFierHexaferrumIndiuIridiuKamacitKhatyrkitMercurMoschellandsbergitNichelOsmiuPaladiuPlatinăPlumbReniuRodiuRuteniuSkaergaarditStaniuTaenitTitanZhanghengitZincAllabogdanitCohenitHapkeitHaxonitRoalditSchreibersitSuessitTongbaitXifengitArsenBismutChaoitDiamantFulleritGrafitLonsdaleitSeleniuSiliciuStibiuSulfTelurMoissanitNieritSinoitBrownleeitTantal
(function(){var node=document.getElementById("mw-dismissablenotice-anonplace");if(node){node.outerHTML="u003Cdiv class="mw-dismissable-notice"u003Eu003Cdiv class="mw-dismissable-notice-close"u003E[u003Ca tabindex="0" role="button"u003Eascundeu003C/au003E]u003C/divu003Eu003Cdiv class="mw-dismissable-notice-body"u003Eu003Cdiv id="localNotice" lang="ro" dir="ltr"u003Eu003Cdiv class="plainlinks" style="border: 1px solid #ddd; margin: 0 0 3px;"u003Enu003Cdiv class="nomobile" style="float:right"u003Eu003Ca href="/wiki/Wikipedia:Wikimedia_CEE_Spring_2019" title="Wikipedia:Wikimedia CEE Spring 2019"u003Eu003Cimg alt="Logo original-t.png" src="//upload.wikimedia.org/wikipedia/commons/thumb/d/d3/Logo_original-t.png/171px-Logo_original-t.png" decoding="async" width="171" height="95" srcset="//upload.wikimedia.org/wikipedia/commons/thumb/d/d3/Logo_original-t.png/258px-Logo_original-t.png 1.5x, //upload.wikimedia.org/wikipedia/commons/thumb/d/d3/Logo_original-t.png/342px-Logo_original-t.png 2x" data-file-width="1800" data-file-height="1000" /u003Eu003C/au003Eu003C/divu003Enu003Cdiv style="color: grey; max-width:1280px; margin: 12px auto; font-family: Tahoma, u0026#39;DejaVu Sans Condensedu0026#39;, sans-serif; text-align: center; font-size: 16pt; position: relative;"u003EVă invităm să participați la concursul u003Ca href="/wiki/Wikipedia:Wikimedia_CEE_Spring_2019" title="Wikipedia:Wikimedia CEE Spring 2019"u003EWikimedia CEE Springu003C/au003E. Săptămâna aceasta sunt promovate articolele propuse de wikipediștii din u003Ca href="https://meta.wikimedia.org/wiki/Wikimedia_CEE_Spring_2019/Structure/Albania" class="extiw" title="m:Wikimedia CEE Spring 2019/Structure/Albania"u003EAlbaniau003C/au003E, u003Ca href="https://meta.wikimedia.org/wiki/Wikimedia_CEE_Spring_2019/Structure/Hungary" class="extiw" title="m:Wikimedia CEE Spring 2019/Structure/Hungary"u003EUngariau003C/au003E, u003Ca href="https://meta.wikimedia.org/wiki/Wikimedia_CEE_Spring_2019/Structure/Erzya" class="extiw" title="m:Wikimedia CEE Spring 2019/Structure/Erzya"u003EErziau003C/au003E.u003C/divu003Enu003Cdiv style="clear: both;"u003Eu003C/divu003Enu003C/divu003Eu003C/divu003Eu003C/divu003Eu003C/divu003E";}}());
Aluminiu
Jump to navigation
Jump to search
| Aluminiu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informații generale | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Nume, Simbol, Număr | Aluminiu, Al, 13 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Serie chimică | metale de post-tranziție | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Grupă, Perioadă, Bloc | 13, 3, 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Densitate | 2700 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Culoare | alb metalic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Număr CAS | 7429-90-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Număr EINECS | 231-072-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți atomice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Masă atomică | 26,981538 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Rază atomică | 125 (118) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Rază de covalență | 118 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Rază van der Waals | 205 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Configurație electronică | [Ne] 3s2 3p1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Electroni pe nivelul de energie | 2, 8, 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Număr de oxidare | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Oxid | amfoter | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Structură cristalină | cubică cu fețe centrate | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți fizice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Fază ordinară | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Punct de topire | 660,3 °C, 933,47 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Punct de fierbere | 2518,9 °C, 2792 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Energie de fuziune | 10,79 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Energie de evaporare | 293,4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Temperatură critică | K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Presiune critică | Pa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Volum molar | 10,00×10-6m³/kmol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Presiune de vapori | 2,42×10-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Viteza sunetului | 6400 m/s la 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forță magnetică | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informații diverse | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Electronegativitate (Pauling) | 1,61 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Căldură specifică | 900 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Conductivitate electrică | 37,7×106S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Conductivitate termică | 237 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prima energie de ionizare | 577,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 2-a energie de ionizare | 1816,7 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 3-a energie de ionizare | 2744,8 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 4-a energie de ionizare | 11.577 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 5-a energie de ionizare | 14.842 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 6-a energie de ionizare | 18.379 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 7-a energie de ionizare | 23.326 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 8-a energie de ionizare | 27.465 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 9-a energie de ionizare | 31.853 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 10-a energie de ionizare | 38.473 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cei mai stabili izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauții | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Unitățile SI și condiții de temperatură și presiune normale dacă nu s-a specificat altfel. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Modifică text | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Modelul atomic
Aluminiul este un element chimic, notat cu simbolul Al. Numărul atomic al aluminiului are valoarea 13, iar masa atomică este 26.97. Este un element chimic comun, ocupând poziția a treia, după oxigen și siliciu, ca răspândire terestră, existând în procent de 7.4%.[1] Compușii aluminiului constituie 8.13% din scoarța terestră,[2] fiind întâlniți în substanțele minerale, precum și în lumea vegetală și animală.[3]
În stare naturală este întâlnit sub forma mineralelor, dintre care amintim silicații,[4] silicoaluminații (feldspat, mică, argile), criolitul (fluoaluminat de sodiu), bauxita, corindonul.
După fier, acesta a devenit metalul cu cea mai largă întrebuințare.[5] Aluminiul a fost remarcat pentru faptul că este un metal ușor, cu o densitate de 2.7 g/cm3. Această calitate îl face să fie utilizat în cantități mari în industria navală și aeronautică. Capacitatea mare de reflexie este folosită în construirea oglinzilor metalice.
Este un bun conducător electric și termic, fiind folosit în industria electrochimică sub formă de sârmă, înlocuind conductoarele electrice din cupru, care sunt mai scumpe.
Este un metal ductil și maleabil, fiind posibilă obținerea unei foițe subțiri de 0.005 mm grosime. Totodată, această proprietate este utilizată în industria alimentară, aluminiul fiind folosit la ambalarea produselor alimentare sau în industria farmaceutică.
O altă proprietate importantă a acestui metal este rezistența la coroziune, care se datorează formării unui strat protector de oxid. Rezistă la acțiunea chimică a acidului azotic diluat sau concentrat, iar acest lucru se reflectă în fabricarea canistrelor transportoare de acid azotic din aluminiu.
Prezintă o afinitate mare pentru oxigen, fiind utilizat în obținerea altor metale precum Cr, Mn, Co, V din oxizi.
Cuprins
1 Istoric
2 Proprietăți
2.1 Proprietăți fizice
2.2 Proprietăți chimice
3 Compuși
4 Răspândire
5 Producere
5.1 Recuperarea aluminiului din deșeuri
5.2 Preparare în laborator
5.3 Producere la scară industrială
6 Utilizare
7 Note
8 Vezi și
9 Legături externe
10 Bibliografie
Istoric |
Termenul "alumen," care este tradus în "alaun," apare în lucrarea lui Pliniu cel Bătrân, Naturalis Historia, capitolul 15 al cărții 35, furnizând detalii despre acest metal. Deși diferite substanțe erau deosebite prin numele de alumen, toate erau caracterizate de un anumit grad de astringență, fiind utilizate în medicină[6] sau ca vopsele.[7].

Statuia lui Anteros (confundat cu Eros sau cu Îngerul Creștin al Carității[8]) în Piccadilly Circus din Londra, confecționată în 1893 și prima statuie făcută din aluminiu.
În anul 1760, un anumit oxid metalic care prezenta stabilitate și nu putea fi redus a fost extras din alaun și numit alumină de către chimistul francez L.G.Morveau. În 1807 Sir Humphry Davy a concluzionat că reducerea compușilor chimici stabili ar trebui să se facă electrolitic cu ajutorul unei noi celule voltaice, reușind obținerea sodiului, potasiului, bariului, stronțiului și al calciului în formă metalică. Pentru această demonstrație remarcabilă a puterii electrochimice, Davy a obținut un premiu de 50.000 de franci din partea lui Napoleon. Deși eșuase în încercările sale de a obține acest element, denumindu-l aluminiu, era evident că restul metalelor obținute de el prezentau un caracter reducător mai puternic decât al carbonului și al hidrogenului.
În 1808 reușește să obțină pentru prima dată bor elementar prin reducerea oxidului boric cu potasiu obținut prin electroliză. Pierre Berthier descoperă în anul 1821 lângă Baux-de-Provence o mină în care exista un mineral ce conținea mai mult de 50% de oxid de aluminiu. Mineralul va fi numit bauxită.
Cercetarea aluminiului metalic a fost continuată de către chimistul danez Hans Christian Oersted, care descrie în 1825 Societății Filosofiei Naturale o metodă de reducere a clorurii de aluminiu la o formă metalică cu ajutorul unui amalgam mercuric al potasiului[6]. Mercurul din amalgam era treptat îndepărtat prin distilare, produsul rezultat fiind o pulbere gri, care a fost descrisă ca aluminiu, deși era posibil să fi conținut o cantitate mare de oxid.
În 1827, Wohler îmbunătățise metoda de reducere propusă de Oersted prin utilizarea unui proces gazos în care triclorura de aluminiu volatilizată reacționa cu potasiul metalic. Potasiul era un metal rar și foarte reactiv, iar triclorura de aluminiu, datorită higroscopicității sale era un material cu care se lucra greu. Experimentele inițiale ale lui Wohler produceau cantități mici de pudră de aluminiu, însă nu constau baza producerii aluminiului în masă.
Munca sa timpurie asupra aluminiului a fost abandonată până în anul 1854, când a modificat procesul astfel încât a produs globule mici și strălucitoare, care erau suficient de pure pentru confirmarea densității reduse a aluminiului și pentru stabilirea ductilității și a caracteristicilor chimice.
Chimistul francez Henri Etienne Sainte-Claire Deville a îmbunătățit de asemenea metoda lui Wohler în 1846, descriindu-le în anul 1859, printre care afișase și propunerea folosirii sodiului în locul potasiului costisitor.
Aluminiul a fost ales drept material pentru vârful Monumentului Washington în 1884, când o uncie (30 g) de aluminiu costa cât salariul zilnic al unui colaborator la acel proiect; aluminiul era la fel de valoros ca și argintul. În anul 1886, Charles Martin Hall, student la colegiul Oberlin, a obținut cantități mici de aluminiu prin electroliza oxidului de aluminiu dizolvat în criolit topit, folosind electrozi de cărbune.
Cu toate că procesele de extragere au suferit îmbunătățiri, preturile scădeau încontinuu, iar în 1889 se descoperise un procedeu simplu de extragere al aluminiului. Invenția dinamului de către Siemens în anul 1866 a ușurat producerea procesului de electroliză pentru extragerea metalului. Procesul Hall-Heroult din 1886 și procesul Bayer din 1887 marchează începutul aplicațiilor multiple ale aluminiului. Utilizarea acestui metal ca material de construcție a devenit atât de răspândită, încât a fost folosit în Sydney, Australia unde a fost folosit la construirea cupolei Secretariatului clădirii.
Anul 1900 marchează perioada când producția mondială de aluminiu a ajuns la 6700 de tone, 1939 cu 700000 de tone și 1943 cu 2.000.000 de tone, datorită celui de-al Doilea Război Mondial. De atunci, producția crescuse mai mult decât cea a celorlalte metale neferoase.
Anul 2008 marchează perioada când prețul aluminiului a atins apogeul în iulie, fiind cotat la 1.45 dolari per livră, însă a scăzut în decembrie la 0.7 dolari per livră.[9]
Proprietăți |
Proprietăți fizice |
- metal de culoare alb metalic- densitate mica 2,7 g/cm cub- bun conductor electric si termic- putere de reflexie mare- formeaza aliaje- duraluminiu
- temperatura de topire 660 grade celsiu
- este maleabil
- este ductil
-aliajele de aluminiu au o resistenta la tractiune cuprinsa intre 70 si 700 MPa. Aliajele sunt cele mai utilizate pe scara larga pentru extrudare, au rezistente cuprinse intre 150-300MPa. Spre deosebire de cele mai multe clase de oteluri, aluminiul nu devine casant la temperaturi joase; in schimb rezistenta sa creste. La temperaturi ridicate, rezistenta aluminiului scade. Atunci când este expus in timp indelungat la temperaturi de peste 100 grade Celsius, rezistenta sa este afectata pana la limita inmuierii.
Proprietăți chimice |
- valența 3
- ionizarea pozitiva
- reacționează cu :
- nemetale
- substanțe compuse
- acizi
- săruri
- oxizi metalici
- Reacția cu nemetale
2Al+3Cl2=2AlCl3{displaystyle 2Al+3Cl2=2AlCl3} (aluminiu + clor = clorură de aluminiu)
4Al + 3O2 = 2Al2O3,
aluminiu + oxigen = oxid de aluminiu
Reacția cu acizii:
2Al + 6HCl = 2AlCl3 + 3H2↑,
aluminiu + acid clorhidric = clorura de aluminiu + hidrogen
Reacția cu săruri:
2Al + Fe2O3 = Al2O3 + 2Fe,
aluminiu + oxid de fier = oxid de aluminiu+ fier
Prin reacțiile aluminiului cu apa, cu oxizii metalici sau cu oxizii nemetalici se obține oxidul de aluminiu.
Compuși |
Cu oxigenul formează oxizi (Al2O3), cu sulful - sulfuri (Al2S3), cu clorul - cloruri (AlCl3).
Răspândire |
Cel mai abundent element metalic din scoarța terestră și al treilea element chimic ca răspândire. Nu se găsește în stare nativă, fiind întâlnit doar în combinații[10] sub formă de minereuri, dintre care cei mai importanți sunt:
silicații și silicoaluminații (SiO2*Al2O3*Fe2O3*H2O argila, K[AlSi3O8] feldspatul, Na[AlSi3O3], albita, mica, etc.)- criolitul Na3[AlF6]
bauxita AlO(OH)- oxidul de aluminiu:Al2O3. În funcție de impuritățile conținute, oxidul de aluminiu poartă următoarele denumiri: corindon(incolor), topaz(galben), rubin(roșu), safir(albastru), ametist(violet), smarald(verde), șmirghelul(negru)[11].
- oxizi micști: MgAl2O4 spinel, BeAl2O4 crisoberil
Bauxita constituie minereul din care se extrage peste 95% din producția mondială de aluminiu. După conținutul lor în aluminiu și fier, bauxitele pot fi albe(foarte bogate în Al2O3, 60-70%), roșii (bogate în Fe2O3, 20-25% și mai sărace în Al2O3, 40-60%) și cenușii (mai sărace în Fe2O3 și Al2O3 decât cele roșii, dar mai bogate în SiO2). Cele mai mari zăcăminte de bauxită se află în Franța.
Producere |
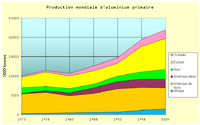
Producția mondială de aluminiu
Exista două căi de producere a aluminiului utilizat în practica industrială:
Aluminiul primar - este aluminiul obținut pe cale directă din bauxită
Aluminiul secundar este aluminiul obținut din recuperarea deșeurilor.
Recuperarea aluminiului din deșeuri |
Recuperarea deșeurilor de aluminiu este o sursă importantă de materie primă pentru metalurgia secundară a aluminiului.
Recuperarea are loc prin topirea deșeurilor sortate, folosind cuptoare de diferite tipuri.
Aluminiul se mai poate obține după reacția: Al2O3+Fe=Fe2O3+Al↓
Consumul de energie pentru obținerea aluminiului recuperat este mai redus decât pentru producerea aluminiului primar, motiv pentru care procedeul este considerat mai favorabil mediului.
Consumul de energie la recuperare se situează în intervalul 500 kJ/to până la 2.000 kJ/to, funcție de tehnologia de ardere și de proces utilizată.
Preparare în laborator |
Producere la scară industrială |
Aluminiul poate fi obtinut din Al2O3 sau din AlCl3 prin reducere cu metale. Reducerea nu se poate face cu carbon, deoarece s-ar forma Al4C3.
AlCl3 + 3Na - Al + 3NaCl
Industrial, aluminiul poate fi obtinut prin prelucrarea bauxitei, care poate avea loc in 2 faze:
- Prepararea aluminei (Al2O3), proces prin care se separa alumina de celelalte impuritati, precum Fe2O3, SiO2, TiO2, etc. Aceasta preparare are loc prin procedeul Bayer, bauxita fiind calcinata la temperatura de 700 °C intr-un cuptor rotativ, in scopul deshidratarii si distrugerii materiilor organice. Are loc un proces de macinare fina si apoi o incalzire sub agitare cu o solutie de NaOH concentrata in autoclave aflate sub presiune de 5 atmosfere si temperaturi de 160-180C, timp de cateva ore. Oxidul de aluminiu trece in solutie sub forma aluminatului de sodiu, Na[Al(OH)4].
Amestecul se filtreaza, solutia de aluminat de sodiu fiind separata de noroaiele-rosii, bogate in Fe2O3 si aluminosilicatul de sodiu insolubil format ca produs secundar, conform reactiilor:
- SiO2+2NaOH = Na2SiO3+H2O
- 2NaAlO2 + 2Na2SiO3 + 2H2O = 3Na2O*Al2O3*2SiO2*2H2O
Cererea globala pentru aluminiu a fost de 36,5 milioane de tone în anul 2008.[12]
În anul 2010, producția mondială a atins 40,4 milioane tone, adică un avans de aproape 10% comparativ cu 2009.[13]
Utilizare |
Este foarte folosit în industrie datorită rezistenței sale la oxidare, proprietăților mecanice bune și densității sale mici. Aluminiul este folosit în industria aerospațială, în construcții, acolo unde este necesar un material ușor și rezistent. Datorită proprietăților electrice bune, aluminiul este folosit și ca material conductor.
Note |
^ Mihai Zapan, Chimie anorganică, Editura tehnică, București, 1968
^ Chimie anorganică, V.Aldea. Editura medicală, București, 1999, tabelul 1.4, pagina 3
^ Tecnología automotriz.Monografías.com Jesús Guevara, Carabolo, Venezuela
^ V.Aldea, op.cit., pagina 4
^ Chimie, manual de clasa a VIII-a, Sanda Fătu, Felicia Stroe, Constantin Stroe, Ed. Corint, 2000
- ^ abNature's building blocks: an A-Z guide to the elements By John Emsley, pagina 23
^ Nature's building blocks: an A-Z guide to the elements By John Emsley, pagina 22
^ virtute creştină, care poate fi corelată cu noţiunea de Agape
^ Prețurile aluminiului
^ V.Aldea, op.cit., pagina 5
^ I.Grecu, Chimie anorganică, Editura didactică și pedagogică, București, 1964, pagina 465
^ Mogulul aluminiului: Vremurile bune ale industriei au apus, 2 februarie 2009, Andreea Neferu, Ziarul financiar, accesat la 19 mai 2012
^ Productia mondiala de aluminiu a crescut cu 3,6%, 27 Ianuarie 2011, Simona Haiduc, accesat la 19 mai 2012
Vezi și |
- Lista elementelor chimice după nume
- Tabelul periodic al elementelor
Legături externe |
- Aluminiul pe sistemul-periodic.go.ro
Aluminiul pe care-l mancam fara sa stim, 23 iulie 2012, Teodor Dănălache, CrestinOrtodox.ro
Bibliografie |
- V.Aldea, Chimie anorganică, Editura Medicală, București, 1999
- I.Grecu, Chimie anorganică, Editura Didactică și Pedagogică, București, 1964
- Christoph Schmitz, "Handbook of aluminium recycling"
- M. Dinu, Metale de înaltă puritate, Editura Tehnică, București, 1988
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||
Categorie:
- Aluminiu
(RLQ=window.RLQ||[]).push(function(){mw.config.set({"wgPageParseReport":{"limitreport":{"cputime":"0.484","walltime":"0.675","ppvisitednodes":{"value":4643,"limit":1000000},"ppgeneratednodes":{"value":0,"limit":1500000},"postexpandincludesize":{"value":212430,"limit":2097152},"templateargumentsize":{"value":62739,"limit":2097152},"expansiondepth":{"value":16,"limit":40},"expensivefunctioncount":{"value":6,"limit":500},"unstrip-depth":{"value":0,"limit":20},"unstrip-size":{"value":4324,"limit":5000000},"entityaccesscount":{"value":1,"limit":400},"timingprofile":["100.00% 444.245 1 -total"," 67.03% 297.756 1 Format:Infocaseta_Element_chimic"," 15.99% 71.048 1 Format:Infocaseta_Element_chimic/mini_tabel_periodic"," 14.17% 62.968 2 Format:Casetă_de_navigare_simplă"," 12.07% 53.614 118 Format:Infocaseta_Element_chimic/mini_tabel_periodic/formatare"," 10.18% 45.213 1 Format:Elemente_chimice"," 10.12% 44.956 1 Format:Informații_bibliotecare"," 5.44% 24.155 1 Format:Elemente_native"," 2.80% 12.441 1 Format:Listănote"," 1.49% 6.635 1 Format:Infodoc"]},"scribunto":{"limitreport-timeusage":{"value":"0.105","limit":"10.000"},"limitreport-memusage":{"value":2706498,"limit":52428800}},"cachereport":{"origin":"mw1269","timestamp":"20190521114628","ttl":2592000,"transientcontent":false}}});});{"@context":"https://schema.org","@type":"Article","name":"Aluminiu","url":"https://ro.wikipedia.org/wiki/Aluminiu","sameAs":"http://www.wikidata.org/entity/Q663","mainEntity":"http://www.wikidata.org/entity/Q663","author":{"@type":"Organization","name":"Contributors to Wikimedia projects"},"publisher":{"@type":"Organization","name":"Wikimedia Foundation, Inc.","logo":{"@type":"ImageObject","url":"https://www.wikimedia.org/static/images/wmf-hor-googpub.png"}},"datePublished":"2006-10-02T15:08:57Z","dateModified":"2018-12-21T10:54:14Z","image":"https://upload.wikimedia.org/wikipedia/commons/5/5d/Aluminium-4.jpg","headline":"elementul chimic cu numu0103rul de ordine 13"}(RLQ=window.RLQ||[]).push(function(){mw.config.set({"wgBackendResponseTime":134,"wgHostname":"mw1252"});});
